平台介绍
真实世界研究的概念最早于1966年由Williamson和Barrett提出,近年来逐渐受到大家的关注。RWE是指从RCT以外的其它来源获取的关于用药方式、药物潜在获益或者安全性方面的数据,包括电子健康档案、医疗保险理赔与账单、药品与疾病登记单以及个人医疗器械与保健活动中收集来的数据。《21世纪治愈法案》发布后,业内人士认为RWE会在加快药品获批速度的同时,降低审评的科学性。基于这些担忧,2016年12月,FDA在《New England Journal of Medicine》上发表《Real-World Evidencce—What is it and what can it tell us?》一文,系统阐述RWE获取数据的环境界定以及研究方法。2017年9月,FDA接受RWE用于医疗器械注册。目前,在ClinicalTrials.gov上可以检索到许多已经完成或正在进行中的RWE试验。在FDA大力推进的背景下,结合其宽纳入、少排除及真实性等优势,RWE必将在加快药品和医疗器械的审批中发挥重要的作用。
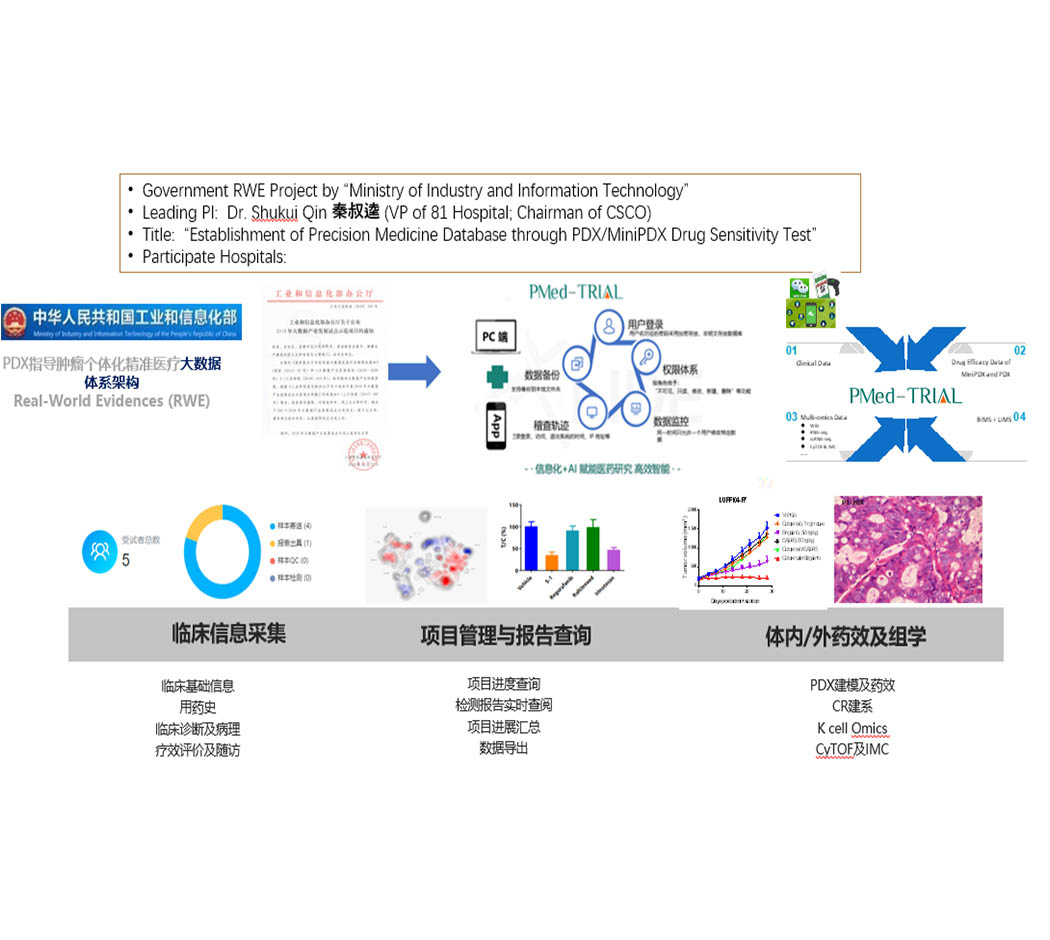
作为秦叔逵教授牵头的国家工信部2018年RWE大数据项目《基于PDX模型的肿瘤个体化精准医疗大数据平台的建立与应用研究》的主要支持单位,基于构建万人数据量级的中国人群癌症重大疾病临床生命组学数据库、肿瘤患者临床表型数据库、PDX模型和MiniPDX药效表型数据库的需求,上海立迪生物技术股份有限公司自主开发了一套精准医疗及临床试验精细化管理的数据系统PMed-Trial。将申办者、机构、伦理、科室、CRA、CRC以及受试者整合在一个综合性管理平台,旨在提供临床试验一站式的全流程服务解决方案。
PMed-Trial是为临床研究打造的智能化数据管理平台,涵盖临床试验研究和临检实验室数据,同时还可实现项目实时管控;为药物临床研究提供精准、有力的数据支撑,助力临床实现肿瘤个体化精准医疗。
系统特点
精准医疗
功能性检测指导肿瘤个体化精准医疗
全面的法规依从性
系统符合NMPA、FDA对临床数据采集,和ISO数据管理体系的要求
安全稳定的数据存储
系统从角色权限管理、稽查痕迹、数据备份等各个防护维度实现管控
高效灵活的CRF设计
系统可根据不同的场景进行CRF设计,操作简单访问便捷
文档审阅项目管理一体化
系统支持上传文件、在线预览及项目提醒等流程管理
RWE&PMed-Trial应用场景
RWE真实世界研究项目
PI发起的IIT研究
上市前PhaseI临床试验(实验室部分)
项目流程管理
RWE&PMed-Trial合作医疗机构
复旦大学附属中山医院
复旦大学附属肿瘤医院
同济大学附属上海市肺科医院
同济大学附属东方医院
上海国际医学园区
上海交通大学医学院附属仁济医院
吉林大学中日联谊医院
北京协和医院(等)